Heveny májelégtelenség kezelése hemoadszorpcióval (CytoSorb®) kombinált folyamatos veno-venosus hemodialízissel. Esetismertetés
Geréd Csanád, Kovács Nóra, Ruszkai Zoltán
Pest Megyei Flór Ferenc Kórház, Aneszteziológiai és Intenzív Terápiás Osztály
Levelező szerző: Dr. Ruszkai Zoltán, PhD; ruszkai.zoltan@florhosp.hu
Bevezetés
A pathofiziológiai háttér ismerete, az elsővonalbeli terápiás, valamint az adjuváns szervtámogató, szervpótló kezelési lehetőségek bővülése ellenére a heveny májelégtelenség mortalitása – etiológiától függetlenül – továbbra is magas az intenzíves betegpopulációban. Ennek oka egyrészt a többszervi diszfunkciót okozó metabolikus és – jellemzően diszregulált hiperinflammáció képében jelentkező - immunológiai működészavar, másrészt a rendkívül komplex, speciális eszközigényű májpótló kezelések (pl. Prometheus, MARS, ADVOS, Single Pass Albumin Dilaysis – SPAD, High Volume Plasma Exchange - HVPE, stb.) korlátozott hozzáférhetősége is.
Bár nincs egyértelmű definíciója az akut májelégtelenségnek, mind a toxikus vagy vírusinfekció-indukált primer, mind a cholestatikus vagy hypoxiás talajon kialakult szekunder formákra jellemző a progresszív coagulopathia, encephalopathia, valamint az epesevak és a bilirubin szérumszintjének emelkedése. A súlyos májműködési zavar az epesevak intrahepatikus akkumulációjához, és mintegy circulus vitiosusként további májsejtkárosodáshoz vezet. A szérum bilirubin szint egyértelműen korrelál az epesavak szérumszintjével, így az állapotsúlyosság markereként és a terápiás intervenciók bevezetésének triggereként értelmezhető.(1)
A szupportív májpótló kezelések alapvető célja a további hepatocyta károsodás megelőzése a vér - hepatotoxikus ágensektől, keringő epesavaktól, bilirubintól, merkaptánoktól, citokinektől, stb. történő - extrakorporális megtisztítása révén. A korábban említett speciális kezelések ígéretes alternatívája – megfelelő effektivitása, széles körű elérhetősége és könnyű kivitelezhetősége miatt - a hemoadszorpcióval kombinált folyamatos veno-venosus hemodialízis (CVVHD).(2) Az eljárás során egy – az alkalmazott eszközre jellemző maximális molekulaméretű anyagokat nagy kapacitással megkötni képes – adszorbert (pl. CytoSorb®, CytoSorbents Europe GmbH, Berlin) helyeznek a dialíziskörbe a dialízis membrán elé, egy kettős extrakorporális eliminációs rendszert hozva létre. A két kezelés kombinációja során a korábban említett nagy fehérjekötődésű és/vagy lipidoldékony „klasszikus májtoxinok” eltávolítása a hemoadszorpció, míg a vízoldékony, kis molekulatömegű anyagok eliminációja (pl. a hepatikus encephalopathiáért felelős ammónia) a CVVHD révén történik meg. A CytoSorb® egy mintegy 40000 m2 felülettel rendelkező biokompatibilis hemoadszorber, mely aspecifikus, koncentrációfüggő módon, nagy kapacitással képes az 5-55 kD méretű molekulákat eltávolítani a vérből. Azon kívül, hogy ebből adódóan rendkívül effektíven távolítja el a bilirubint és az epesavakat, a keringő citokinek, interleukinok és prokalcitonin adszorpciója révén hozzájárul a májelégtelenséghez kapcsolódó diszregulált immunválasz kiegyensúlyozásához, így a hiperinflammáció okozta többszervi károsodás csökkentéséhez.(3) A kezelés egyértelmű előnyeit számos esetismertetésben leírták, és az utóbbi időben több kontrollált klinikai vizsgálatban is igazolták.(1),(4),(5),(6),(7) A téma fontosságát és időszerűségét jelzi egy nemrég megjelent, regiszter-alapú analízis, illetve jelenleg folyamatban van egy meta-analízis is, mely reményeink szerint a még nyitott kérdésekre is választ fog adni.(8)
Jelen esetleírásunkban egy alkohol hepatitis talaján kialakult heveny májelégtelenség miatt intenzív osztályunkon kezelt betegünk CytoSorb-bal kombinált CVVHD kezelését ismertetjük.
Esetismertetés
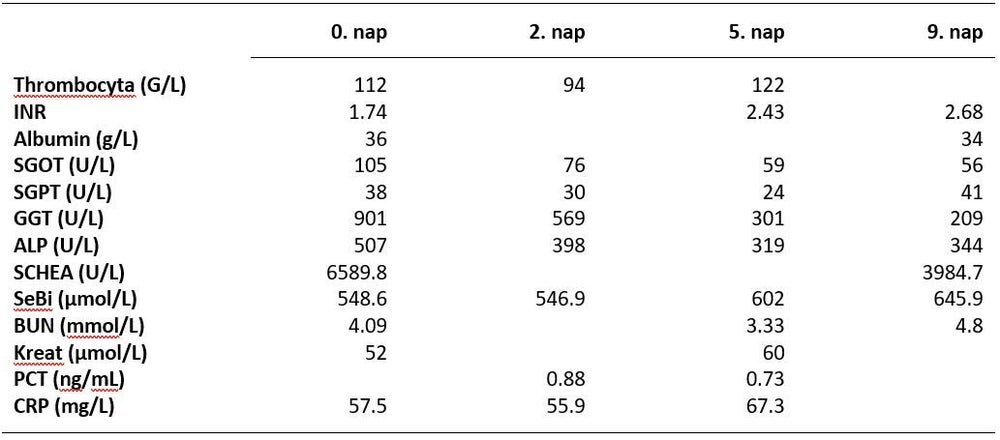
34 éves férfibetegünk 10-12 nappal korábban kezdődött, progrediáló icterus miatt került felvételre kórházunk Gastroenterológiai Osztályára. Távolabbi anamnézisében gyermekkori appendectomián kívül egyéb érdemi betegség nem szerepelt. Belgyógyászati kivizsgálása során hasi UH vizsgálat hepato-splenomegáliát és megvastagodott falú, kőmentes cholecystát igazolt, laborjaiban emelkedett transzaminázokat és epeúti obstrukciós enzimeket, extrém magas szérum bilirubin szintet és megnyúlt INR-t észleltek, SCHEA aktivitása normál tartományban volt. Sebészi konzílium - tekintettel a nem emelkedett gyulladásos markerekre – urgens műtéti beavatkozást nem tartott szükségesnek. A májkárosodás etiológiájának tisztázása céljából további képalkotó (hasi CT, MR cholangiográfia), valamint vírusszerológiai (HIV, HAV, HBV, HCV, EBV) vizsgálatok történtek, melyek sem epeúti kövességet, sem vírusinfekciót nem igazoltak. Autoantitestek negatívak voltak, szérum vas, réz és coeruloplazmin szint sem volt emelkedett. Májbiopszia során toxikus parenchyma károsodásra utaló morfológiai kép, kifejezett cholestasis, mérsékelt fibrosis és steatosis szöveti jelei igazolódtak, a minta immunhisztokémiai feldolgozása autoimmun eredetet szintén kizárt. A beteg végül elismerte a hosszabb ideje fennálló nagy mennyiségű alkoholfogyasztást, ezért alkoholos hepatitis miatt thiamin és pyridoxin szupplementációt, valamint kortikoszteroid kezelést kezdtek, - intrahepatikus cholestasisa miatt - ursodezoxycholsav adagolásával együtt. A bevezetett szupportív terápia ellenére a beteg klinikai állapota fokozatosan romlott, labor eredményeiben fokozódó cholestasis és coagulopathia látszott (1. Táblázat). Oliguria hepatorenális szindróma (KDIGO AKI I) kialakulását jelezte a még normális vesefunkciós paraméterek ellenére. Többszervi diszfunkciót okozó, progrediáló májelégtelenség miatt, belgyógyászati kezelése 9. napján Intenzív Osztályunkra átvettük. Állapotsúlyossági mutatói átvételekor: APACHE II: 8 pont; SAPS II: 31 pont; SOFA: 13 pont; MELD Score: 31 pont voltak.
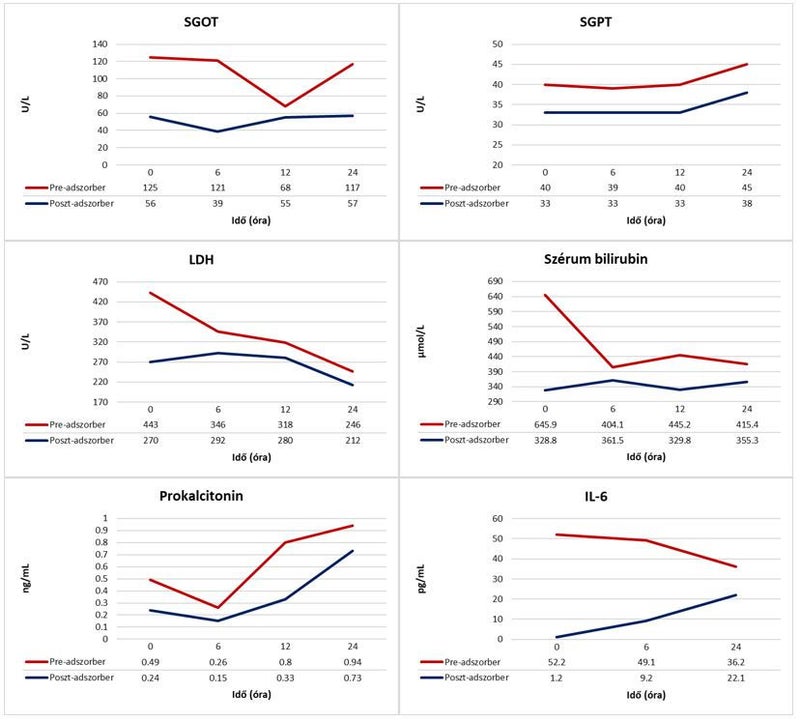
Felvételét követően komplex szervpótló kezelést – CytoSorb® hemoadszorberrel kombinált CVVHD (OMNI®, B. Braun Avitum AG, Hessen) – indítottunk. Betegünk klinikai állapotának változását, valamint a kezelés hatékonyságát annak megkezdésekor, majd 6, 12 és 24 órával később, a CytoSorb® előtt (pre-adszorber) és közvetlenül utána (poszt-adszorber) vett vérminták laboratóriumi vizsgálatával monitoroztuk. Bár a hemoadszorpciós kezelés végén az átmenetileg emelkedő transzamináz (SGOT, SGPT), valamint PCT és IL-6 szintek az inflammáció fokozódására utaltak, 24 óra alatt jelentős szérum bilirubin csökkenést értünk el (seBiT0 = 645.9 µmol/L vs. seBiT24 = 355.3 µmol/L), a cholestasis oldódására a szintén csökkenő LDH szint utalt (1. Ábra).
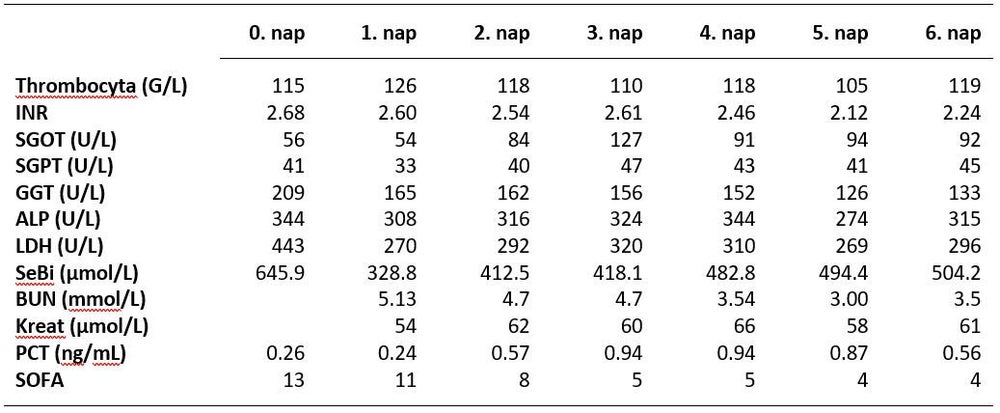
A hemoadszorbert 24 óra után eltávolítottuk, CVVHD kezelését további 4 napig folytattuk. Betegünk szervdiszfunkciói javultak, melyet a SOFA Score csökkenése jelzett. Mivel a gyulladásos markerek diszkrét emelkedéséhez keringési instabilitás, vazopresszor-igény nem társult, újabb hemoadszorpciós kezelést nem végeztünk. Annak ellenére, hogy a CVVHD kezelés mellett szérum bilirubin szintjében enyhén emelkedő tendenciát észleltünk, cholestasisa csökkent (2. Táblázat), transzamináz értékei nem emelkedtek tovább, diuresise rendeződött, keringési paraméterei stabilak voltak, szérum ammónia szintje normál tartományban volt, tudata mindvégig tiszta maradt, így 6 nap intenzív osztályos kezelést követően Gastroenterológiai Osztályra emittáltuk, ahonnan 7 nap további kezelést követően, kielégítő általános állapotban otthonába bocsájtották.
Megbeszélés
Esetleírásunkban egy 34 éves, alkoholos hepatitis talaján kialakult heveny májelégtelen férfibetegünk sikeres szupportív kezelését ismertettük. Betegünk ellátása során CytoSorb® hemoadszorberrel kombinált CVVHD kezelést alkalmaztunk. A hemoadszorpció révén 24 óra alatt jelentős (kb. 50%) szérum bilirubinszint-csökkenést értünk el, emellett a normalizálódó vesefunkció, a diuresis rendeződése a szisztémás gyulladás csillapítására és kiegyensúlyozására utalt. A CVVHD mellett ammónia-szintje normál tartományban maradt, tudata mindvégig megtartott volt. Fontos hangsúlyozni, hogy a májelégtelenség során alkalmazott extrakorporális vértisztító kezelés szupportív, adjuváns beavatkozás, - azaz az alapbetegség kezelésére önmagában nem, csak a kiesett exkréciós-eliminációs folyamatok pótlására, ezáltal a szövődmények, további károsodások csökkentésére, a májfunkció kielégítővé válásáig „idő nyerésére” alkalmas - így nem helyettesíti (az esetünkben kortikoszteroid, thiamin- és nagy dózisú pyridoxin-szubsztitúción alapuló) standard gyógyszeres terápiát. A kezelés indikációjának felállítása során alapvető fontosságú egyrészt az elérendő cél megfogalmazása (akut életmentő kezelés, bridging a tervezett transzplantációig, stb.), másrészt a beteg gyógyulási esélyének, azaz a máj még meglévő reziduális funkciójának és regenerálódási lehetőségének felmérése. Az általunk alkalmazott kezelés legfőbb előnyei - hatékonysága mellett - a szofisztikált májpótló kezelésekkel szemben (melyek ismertetése meghaladja jelen esetismertetésünk kereteit) széles körű elérhetősége, univerzális és könnyű alkalmazhatósága, valamint az alacsonyabb költsége.
Irodalom
1. Scharf C, Liebchen U, Paal M, et al. Successful elimination of bilirubin in critically ill patients with acute liver dysfunction using a cytokine adsorber and albumin dialysis: a pilot study. Sci Rep 2021; 11:10190. doi: 10.1038/s41598-021-89712-4
2. Dhokia VD, Madhavan D, Austin A et al. Novel use of CytoSorb™ haemoadsorption to provide biochemical control in liver impairment. J Intensive Care Soc 2019; 20(2):174-181. doi: 10.1177/1751143718772789
3. Morris C, Gray L, Giovanelli M. Early report: the use of CytoSorb™ haemoadsorption column as an adjunct in managing severe sepsis: initial experiences, review and recommendations. J Intensive Care Soc 2015; 16:257-264.
4. Tomescu DR, Olimpia Dima S, Ungureanu D, et al. First report of cytokine removal using CytoSorb® in severe nonifectious inflammatory syndrome after liver transplantation. Int J Artif Organs 2016; 39:136-140.
5. Faltlhauser A, Kullmann F. Use of hemoadsorption in a case of severe hepatic failure and hyperbilirubunaemia. Blood Purif 2017; 44:98-99.
6. Acar U, et al. Impact of cytokine adsorption treatment in liver failure. Transpl Proc 2019; 51(7):2420-2424.
7. Calabro MG, et al. Blood purification with CytoSorb in critically ill patients: single-center preliminary experience. Artif Organs 2019; 43(2):189-194.
8. Ocskay K, Tomescu D, Faltlhauser A, et al. Hemoadsorption in ’Liver Indication’ – Analysis of 109 Patients’ Data from the CytoSorb International Registry. J Clin Med 2021; 11. doi: 10.3390/jcm10215182